Հեղինակ:
Lewis Jackson
Ստեղծման Ամսաթիվը:
8 Մայիս 2021
Թարմացման Ամսաթիվը:
25 Հունիս 2024
Բովանդակություն
Անցային իոնային հավասարումը քիմիայի կարևոր մաս է, քանի որ այն ներկայացնում է միայն քիմիական ռեակցիայի մեջ փոփոխվող մասնիկները: Դրանք առավել հաճախ օգտագործվում են օքսիդացման-նվազեցման ռեակցիաների, նյութափոխանակության ռեակցիաների և թթուների ՝ հիմքերի չեզոքացման ռեակցիաների ժամանակ: Ուտ իոնային հավասարություն գրելու համար կան երեք հիմնական քայլեր. Հավասարակշռել մոլեկուլային հավասարումը, փոխակերպել այն իոնական լրիվ հավասարության (ըստ այն բանի, թե ինչպես է յուրաքանչյուր նյութ գոյություն ունենում լուծույթում) և վերջապես գրել զուտ իոնային հավասարումը:
Քայլեր
2-րդ մասի 1-ը. Իոնական հավասարման բաղադրիչների ըմբռնումը
Իմացեք մոլեկուլների և իոնային միացություններ. Ուտ իոնային հավասարություն գրելու առաջին քայլը ռեակցիայի մեջ իոնային միացությունների որոշումն է: Իոնային միացություններն այն են, որոնք իոնները ջրային լուծույթում տարանջատում են և ունեն էլեկտրական լիցք: Մոլեկուլային միացությունները միացություններ են, որոնք երբեք էլեկտրական լիցք չունեն: Դրանք առաջանում են երկու ոչ մետաղների միջև և երբեմն կոչվում են կովալենտ միացություններ:
- Իոնային միացությունները կարող են ձեւավորվել մետաղների և ոչ մետաղների, մետաղների և բազմատոմական իոնների կամ բազմապլանատոմական իոնների միջև:
- Եթե վստահ չեք, թե որն է բաղադրությունը, կարող եք այդ բաղադրության տարրերը փնտրել պարբերական համակարգի վրա:

Recանաչել բաղադրության լուծելիությունը: Ոչ բոլոր իոնային միացությունները լուծելի են ջրային լուծույթում, ուստի չեն կարող բաժանվել իոնների: Դուք պետք է նույնականացնեք յուրաքանչյուր բաղադրության լուծելիությունը, նախքան մնացած հավասարմանը անցնելը: Ստորև բերված է լուծելիության կանոնների ամփոփ նկարագրություն: Գտեք լուծելիության աղյուսակ ՝ ավելի մանրամասն տեղեկատվության և այս կանոններից բացառությունների համար:- Հետևեք այս կանոններին ստորև նշված կարգով.
- Na, K և NH բոլոր աղերը4 բոլորը հալվում են:
- Բոլոր ՈՉ ՈՐ աղերը3, Գ2Հ3Ո2, ClO3, և ClO4 բոլորը հալվում են:
- Բոլոր Ag, Pb և Hg աղերը2 բոլորը հալվում են:
- Cl, Br և I բոլոր աղերը լուծելի են:
- Բոլոր CO աղերը3, O, S, OH, PO4, CrO4, Քր2Ո7, եւ այսպես3 լուծարվում են (բացառությամբ մի քանի դեպքերի):
- Բոլոր SO աղերը4 լուծարվում են (բացառությամբ մի քանի դեպքերի):
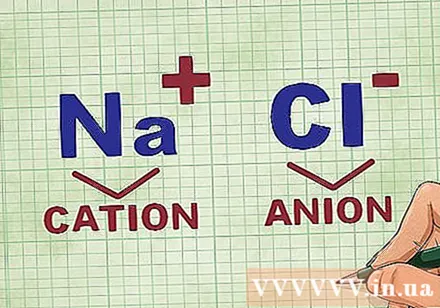
Կատիոնների և անիոնների որոշում բաղադրության մեջ: Կատիոնները բարդ իոնների դրական իոններն են և սովորաբար դրանք մետաղ են: Անիոնը բացասական իոն է բաղադրության մեջ և ոչ մետաղական է: Որոշ ոչ մետաղներ կարող են կատիոններ առաջացնել, բայց մետաղները միշտ կատիոններ են կազմում:- Օրինակ, NaCl- ում Na- ն դրական լիցքավորված կատիոն է, քանի որ այն մետաղ է, իսկ Cl- ը `բացասական լիցքավորված անիոն, քանի որ այն ոչ մետաղ է:

Ռեակցիայի մեջ ճանաչել պոլիատոմային իոնները: Պոլիատոմային իոնները լիցքավորված մոլեկուլներ են, որոնք սերտորեն կապված են միմյանց հետ և չեն բաժանվում քիմիական ռեակցիաների ժամանակ: Կարևոր է ճանաչել պոլիատոմային իոնները, քանի որ դրանք ունեն հատուկ լիցք և չեն բաժանվում: Պոլիատոմային իոնները կարող են ունենալ դրական կամ բացասական լիցք:- Եթե ընդհանուր քիմիա եք ուսումնասիրում, ապա հաճախ պահանջվում է հիշել մի շարք ընդհանուր պոլիատոմային իոններ:
- Որոշ սովորական պոլիատոմային իոններ CO են3, ՈՉ3, ՈՉ2, Ուրեմն4, Ուրեմն3, ClO4 և ClO- ն3.
- Քիմիայի գրքերում կամ ինտերնետում կարող եք գտնել նաև շատ այլ իոններ:
2-րդ մասի 2-րդ մասը. Aուտ իոնային հավասարության գրառում
Հաշվեկշիռ մոլեկուլային հավասարումներ: Նախքան զուտ իոնային հավասարություն գրելը, դուք պետք է համոզվեք, որ ձեր մոլեկուլային հավասարումը հավասարակշռված է: Հավասարությունը հավասարակշռելու համար բաղադրիչի դիմաց գործակիցներ ես ավելացնում այնպես, որ յուրաքանչյուր տարրի ատոմային թիվը հավասար լինի հավասարության երկու կողմերից էլ: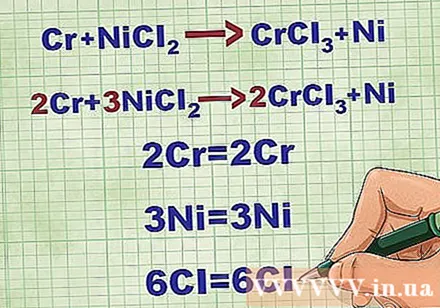
- Գրեք հավասարության երկու կողմերում յուրաքանչյուր բաղադրիչ կազմող ատոմների քանակը:
- Յուրաքանչյուր կողմը հավասարակշռելու համար ավելացրեք գործակից այլ տարրերի դիմաց, բացի թթվածնից և ջրածնից:
- Hydրածնի ատոմի մնացորդ:
- Թթվածնի ատոմային հաշվեկշիռը:
- Վերահաշվարկի հավասարության յուրաքանչյուր կողմում գտնվող ատոմների քանակը ՝ համոզվելու համար, որ դրանք հավասարակշռված են:
- Օրինակ ՝ Cr + NiCl2 -> CrCl3 + Ni Հավասարակշռված է 2Cr + 3NiCl- ով2 -> 2CrCl3 + 3Ni.
Նույնականացնել բաղադրության վիճակը հավասարման մեջ: Խնդրի մեջ շատ անգամներ կան հիմնաբառեր, որոնք թույլ են տալիս իմանալ յուրաքանչյուր բաղադրության վիճակը: Կան մի քանի կանոններ, որոնք կօգնեն որոշել տարրի կամ բաղադրության վիճակը: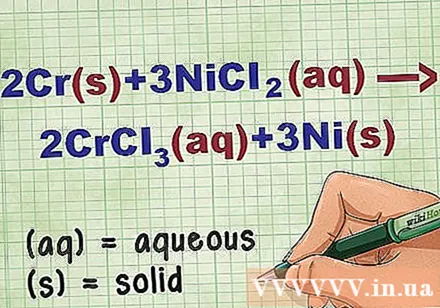
- Եթե տարրի վիճակը տրամադրված չէ, ապա օգտագործիր պարբերական աղյուսակում հայտնաբերված վիճակը:
- Եթե միացությունը կոչվում է լուծույթ, կարող եք այն գրել որպես ջրային կամ (դդ).
- Եթե հավասարման մեջ ջուր կա, դուք պետք է որոշեք ՝ իոնային միացությունը ջրի լուծելի՞ է, օգտագործելով լուծելիության աղյուսակը: Եթե լուծելիությունը բարձր է, բաղադրությունը ջրային կլինի (դդ), եթե լուծելիությունը ցածր է, բաղադրությունը պինդ կլինի (ռ).
- Առանց ջրի, իոնային բաղադրությունը պինդ է (ռ).
- Եթե խնդիրը թթվային է կամ հիմնային, ապա բաղադրությունը ջրային է (դդ).
- Օրինակ ՝ 2Cr + 3NiCl2 -> 2CrCl3 + 3Ni. Cr- ի և Ni- ի տարրական ձևերը գտնվում են ամուր վիճակում: NiCl2 և CrCl3 իոնային միացությունները լուծելի են, ուստի ջրային են: Հավասարությունը շարադրել նոր խմբագրությամբ ՝ 2Cr(ռ) + 3NiCl2(դդ) -> 2CrCl3(դդ) + 3Ni(ռ).
Որոշեք, թե որ միացությունները կբաշխեն լուծույթում (կբաշխվեն կատիոնների և անիոնների): Երբ նյութը կամ բաղադրությունը տարանջատվում է, այն բաժանվում է դրական լիցքավորված իոնի (կատիոն) և բացասական լիցքի իոնի (անիոն): Սրանք այն բաղադրիչներն են, որոնք հավասարակշռված կլինեն զուտ իոնային հավասարման վերջում:
- Պինդ նյութերը, հեղուկները, գազերը, մոլեկուլային միացությունները, ցածր լուծելիությամբ իոնային միացությունները, պոլիատոմական իոնները և թույլ թթուները չեն բաժանվի:
- Իոնային միացությունները ունեն բարձր լուծելիություն (օգտագործիր լուծելիության աղյուսակը) և ուժեղ թթուները իոնացվելու են 100% -ով (HCl(դդ), HBr(դդ), ՈՂՋՈՒ՜ՅՆ(դդ), Հ2ԱՅՍՏԵ4(դդ), HClO4(դդ), և HNO3(դդ)).
- Ուշադրություն դարձրեք, չնայած պոլիատոմային իոններն այլևս չեն բաժանվում, բայց եթե դրանք այդ բաղադրության բաղադրիչն են, դրանք տարանջատվում են միացությունից:
Հաշվեք բաղադրությունից առանձնացված յուրաքանչյուր իոնի լիցքը: Հիշեք, որ մետաղները կստեղծեն դրական իոններ, իսկ ոչ մետաղները ՝ բացասական իոններ: Օգտագործեք պարբերական աղյուսակ ՝ տարրի լիցքը որոշելու համար: Դուք նաև պետք է հավասարակշռեք բաղադրության մեջ պարունակվող յուրաքանչյուր իոնի լիցքը:
- Այս օրինակում NiCl2 տարանջատվել է Ni և Cl, մինչ CrCl3 բաժանվել է Cr- ի և Cl- ի:
- Ni- ն ունի 2+ լիցք, քանի որ Cl- ը ունի բացասական լիցք, բայց ունի 2 ատոմ: Հետեւաբար, մենք պետք է հավասարակշռենք 2 բացասական Cl իոնները: Cr- ն ունի 3+ լիցք, ուստի մենք պետք է հավասարակշռենք 3 բացասական Cl իոնները:
- Հիշեք, որ պոլիատոմային իոնները ունեն հատուկ լիցք:
Գրիր ամբողջական իոնային հավասարումը: Thingանկացած բան, որը տարանջատում կամ իոնացնում է (ուժեղ թթուներ), առանձնանում է երկու առանձին իոնների: Նյութի վիճակը մնում է (դդ), բայց համոզվեք, որ հավասարումը մնում է հավասարակշռված:
- Պինդ նյութերը, հեղուկները, գազերը, թույլ թթուները և ցածր լուծելիությամբ իոնային միացությունները չեն փոխում վիճակը և չեն առանձնանում իոնների: Մենք դրանք անխախտ ենք պահում:
- Մոլեկուլային նյութերը ցրվելու են լուծույթում, որպեսզի դրանց վիճակը փոխվի (դդ) Երեք բացառություն չեն դառնալ (դդ) է ՝ CH4(կ), Գ3Հ8(կ), և Գ8Հ18(լ).
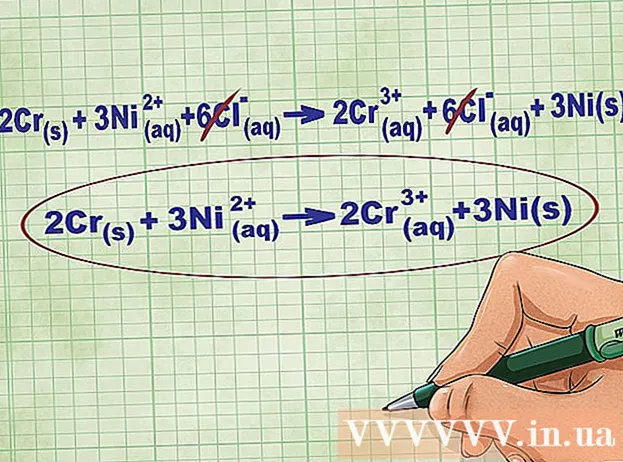
- Շարունակելով վերոնշյալ օրինակը ՝ իոնային լրիվ հավասարումը կարծես այսպիսին է ՝ 2Cr(ռ) + 3Ni(դդ) + 6Cl(դդ) -> 2 Կր(դդ) + 6Cl(դդ) + 3Ni(ռ), Երբ Cl- ը գոյություն չունի մի բաղադրության մեջ, դա երկֆազային նյութ չէ, ուստի մենք բազմապատկում ենք գործակիցը բաղադրության մեջ գտնվող ատոմների քանակով `հավասարության երկու կողմերում ունենալով 6 Cl իոն:
Հեռացրեք հավասարակշռության իոնները ՝ չեղարկելով հավասարության յուրաքանչյուր կողմում նույն իոնները: Դուք կարող եք չեղարկել միայն այն դեպքում, եթե դրանք երկու կողմերում էլ նույնն են (լիցքավորումը, ատոմային թիվը և այլն): Վերաշարադրեք հավասարումը առանց քայքայիչ նյութերի: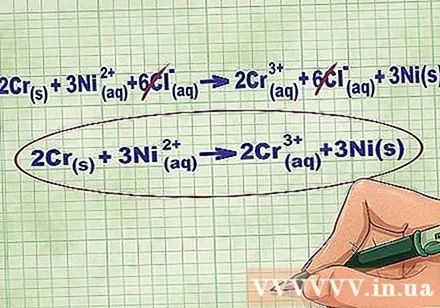
- Օրինակն ամբողջացնելուց հետո յուրաքանչյուր կողմում ունենք 6 չեղարկվող Cl հավասարակշռության իոն: Անցային իոնային հավասարումը 2Cr է(ռ) + 3Ni(դդ) -> 2 Կր(դդ) + 3Ni(ռ).
- Եթե ճիշտ եք, ապա ռեակտիվ կողմի ընդհանուր լիցքը պետք է հավասար լինի զուտ իոնային հավասարման արտադրանքի կողմի ընդհանուր լիցքին:
Խորհուրդներ
- Գրեք բոլոր նյութերի վիճակները հավասարում, եթե ոչ դուք կամք միավորներ կորցնել:



