Հեղինակ:
Randy Alexander
Ստեղծման Ամսաթիվը:
25 Ապրիլ 2021
Թարմացման Ամսաթիվը:
26 Հունիս 2024
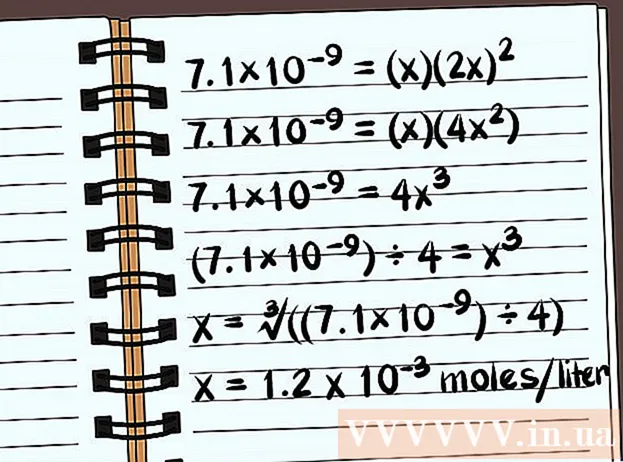
Բովանդակություն
Քիմիայում լուծելիությունն օգտագործվում է պինդ միացության հատկությունները նկարագրելու համար, երբ այն ամբողջությամբ լուծվում է հեղուկի մեջ ՝ առանց թողնելով անլուծելի մնացորդ: Լուծվում են միայն իոնային միացությունները (լիցքավորված): Փաստորեն, անհրաժեշտ է միայն անգիր սովորել մի քանի սկզբունքներ կամ փնտրել գրականությունը ՝ իմանալու, թե արդյոք իոնային միացությունը պինդ կմնա ջրի մեջ ավելացնելիս, թե մեծ քանակությամբ լուծվում է: Իրականում, որոշակի քանակությամբ մոլեկուլներ կլուծվեն, նույնիսկ եթե դուք փոփոխություն չեք տեսնում, այնպես որ փորձի ճշգրիտ լինելու համար դուք պետք է իմանաք, թե ինչպես հաշվարկել լուծվող նյութի այս քանակը:
Քայլեր
2-ի մեթոդ 1. Օգտագործեք արագ կանոններ
Իմացեք իոնային միացությունների մասին: Յուրաքանչյուր ատոմ սովորաբար ունենում է որոշակի քանակությամբ էլեկտրոններ, բայց երբեմն այն ստանում է կամ տալիս է էլեկտրոն: Այս գործընթացը դարձնում է մեկը իոններ գանձվում է Երբ բացասական լիցք ունեցող իոնը (մեկ էլեկտրոնի ավելցուկը) բախվում է դրական լիցքով իոնին (բացակայում է էլեկտրոնը), նրանք կկապվեն միասին, ինչպես երկու մագնիսների կաթոդ և անոդ: Արդյունքն առաջացնում է իոնային միացություն:
- Իոնները կոչվում են բացասական լիցք անիոններ, և իոնները կոչվում են դրական լիցք կատիոն.
- Սովորաբար էլեկտրոնների քանակը ատոմում հավասար է պրոտոնների քանակին, ուստի այն չունի լիցք:

Հասկացեք լուծելիությունը: Molecրի մոլեկուլ (Հ2Ո) անկանոն կառուցվածք ունի, ուստի այն մագնիս է հիշեցնում. Մի ծայրն ունի դրական լիցք, իսկ մյուսը ՝ բացասական: Երբ իոնային միացություն եք դնում ջրի մեջ, ջրի այդ «մագնիսները» հավաքվում են դրա շուրջ ՝ փորձելով տարանջատել դրական և բացասական իոնները:- Իոնային միացությունների մի մասը շատ ամուր չեն ներծծվում, դրանք համարվում են լուծելի Քանի որ այն կբաժանվի և կլուծվի ջրի մեջ ավելացնելիս: Այլ միացություններն ունեն ավելի ամուր կապեր անլուծելի քանի որ իոնները սերտորեն ձգվում են միմյանց ՝ անկախ ջրի մոլեկուլի ձգումից:
- Որոշ միացություններ ունեն ջրի մոլեկուլի ներգրավմանը համարժեք պարտադիր ուժ: Դրանք համարվում են մի փոքր լուծելի քանի որ միացությունների մեծ մասը տարանջատվելու է, բայց մնացածը միևնույն է ձգվելու են միմյանց:

Հասկացեք լուծարման սկզբունքը: Քանի որ ատոմների փոխազդեցությունը շատ բարդ է, դուք չեք կարող ամբողջովին ապավինել ինտուիցիային `տարբերելու, թե որ միացությունները կարող են կամ չեն կարող: Ստորև բերված ցուցակում պարունակվող առաջին իոն փնտրեք նրա ընդհանուր հատկությունների համար, ապա ստուգեք բացառությունները ՝ համոզվելու համար, որ երկրորդ իոնն աննորմալ չի փոխազդում դրա հետ:- Օրինակ ՝ ստրոնցիումի քլորիդը (SrCl) ստուգելու համար2), խնդրում ենք Sr- ը կամ Cl- ը փնտրել ստորև ներկայացված համարձակ քայլերով: Cl- ը «սովորաբար լուծելի է», այնպես որ ստուգեք դրա տակ գտնվող բացառությունները: Sr- ը բացառությունների ցուցակում չէ, ուստի SrCl2 պետք է լուծելի լինի:
- Յուրաքանչյուր կանոնի ամենատարածված բացառությունները գրված են կանոնի տակ: Կան այլ բացառություններ, բայց դրանք դժվար թե պատահեն նորմալ քիմիայի կամ լաբորատոր ժամերի ընթացքում:

Բարդությունները լուծելի են, երբ դրանցում կան ալկալային մետաղներ, ինչպիսիք են Li, Na, K, Rb և C: Այս մետաղները հայտնի են նաև որպես IA խմբի տարրեր ՝ լիթիում, նատրիում, կալիում, ռուբիդիում և ցեզիում: Այս իոններից մեկը պարունակող գրեթե բոլոր միացությունները լուծելի են:- Բացառություն: Լի3PO4 անլուծելի
ՈՉ միացություններ3, Գ2Հ3Ո2, ՈՉ2, ClO3 և ClO- ն4 բոլորը լուծելի են: Վերոնշյալ իոններին համապատասխանող անվանումներն են նիտրատ, ացետատ, նիտրիտ, քլորատ և պերքլորատ: Նշենք, որ ացետատը հաճախ կրճատվում է որպես OAc:
- Բացառություն: Ag (OAc) (արծաթի ացետատ) և Hg (OAc)2 (սնդիկի ացետատ) անլուծելի:
- AgNO2 և KClO4 միայն «մի փոքր հալված»:
Cl, Br և I միացությունները սովորաբար լուծելի են: Քլորիդի, բրոմիդի և յոդիդի իոնները գրեթե միշտ առաջացնում են լուծվող միացություններ, որոնք կոչվում են հալոգենային աղեր:
- Բացառություն: Եթե վերը նշված իոններից որևէ մեկը միավորվում է Ag արծաթի իոնների հետ, ապա սնդիկի Hg2կամ Pb կապարը կստեղծի անլուծելի միացություններ: Նույնը վերաբերում է ավելի քիչ տարածված միացություններին, որոնք առաջացել են պղնձի Cu- ի և thali Tl- ի հետ համատեղելիս:
SO պարունակող միացություններ4 սովորաբար լուծվող: Սուլֆատ իոնները հաճախ առաջացնում են լուծվող միացություններ, բայց կան շատ բացառություններ:
- Բացառություն: Սուլֆատի իոնները կազմում են անլուծելի միացություն հետևյալ իոններով. Ստրոնցիում Sr, բարիում Ba, կապարի Pb, արծաթ Ag, կալցիումի Ca, ռադիում Ra և արծաթի մոնատոմ Ag2, Նշենք, որ արծաթի սուլֆատը և կալցիումի սուլֆատը միայն չափավոր լուծելի են, ուստի ոմանք դրանք համարում են փոքր լուծելի:
OH կամ S պարունակող նյութերն անլուծելի են: Այս իոնների համապատասխան անվանումները հիդրօքսիդներ և սուլֆիդներ են:
- Բացառություն: Հիշու՞մ եք ալկալային մետաղները (I-A խմբեր) և ինչպես են նրանք սիրում լուծվող միացություններ կազմել: Li, Na, K, Rb և Cs բոլորը կազմում են միացություններ, որոնք լուծվում են հիդրօքսիդի կամ սուլֆիդի իոններով: Բացի այդ, հիդրօքսիդները կազմում են աղեր, որոնք լուծելի են ալկալային հողի մետաղի իոններով (II խումբ-Ա խումբ) ՝ կալցիումի Ca, ստրոնցիում Sr և բարիում Ba: Նշում. Հիդրօքսիդներից և հողի ալկալային մետաղներից պատրաստված միացություններն իրականում ունեն զգալի քանակությամբ մոլեկուլներ, որոնք կապված են միմյանց հետ, ուստի դրանք երբեմն համարվում են «փոքր լուծելի»:
CO պարունակող միացություններ3 կամ PO4 անլուծելի Վերջին անգամ ստուգեք կարբոնատ և ֆոսֆատ իոնները, և կտեսնեք, թե արդյոք ձեր բաղադրությունը լուծելի է:
- Բացառություն: Այս իոնները կազմում են միացություններ, որոնք լուծելի են ալկալային մետաղների հետ, ինչպիսիք են Li, Na, K, Rb և C, ինչպես նաև ամոնիումի իոնով NH4.
2-ի մեթոդ 2. Հաշվարկել լուծելիությունը հաստատուն K- իցսպ
Նայեք լուծելիության արտադրանքի կայուն K- ինսպ. Այս հաստատունը տարբեր է յուրաքանչյուր բարդի համար, ուստի այն պետք է փնտրել դասագրքի կամ առցանց գրաֆիկի վրա: Քանի որ այս արժեքները որոշվում են փորձնականորեն և կարող են զգալիորեն տարբերվել գծապատկերների միջև, լավագույն դեպքում օգտագործել դասագրքի գծապատկերը, եթե առկա է: Եթե այլ բան նախատեսված չէ, հողամասերի մեծ մասը ենթադրում է փորձարկման ջերմաստիճան 25ºC:
- Օրինակ, ասենք, որ լուծարում եք կապարի յոդդը PbI բանաձևով2, գրի՛ր դրա լուծելիության արտադրանքի հաստատունը: Եթե դուք վերաբերում եք bilbo.chm.uri.edu- ի գծապատկերին, ապա օգտագործում եք հաստատուն 7,1 × 10:
Գրիր քիմիական հավասարություն: Առաջինը ՝ որոշեք լուծույթի լուծման ժամանակ այս բաղադրության իոնային տարանջատման օրինակը: Դրանից հետո գրիր հավասարումը K- ի հետսպ մի կողմից, իսկ մյուս մասի բաղադրիչ իոնները:
- Օրինակ ՝ PbI մոլեկուլ2 տարանջատվել Pb, I և I իոնների (միայն դուք պետք է իմանաք կամ ստուգեք իոնի լիցքը, քանի որ բոլոր միացությունները միշտ էլեկտրաէներգիայի տեսանկյունից չեզոք են):
- Գրիր 7,1 × 10 = հավասարումը
- Այս հավասարումը լուծելիության հաստատունն է, լուծելիության աղյուսակում կարող եք պարզել 2 իոնների համար: Քանի որ գոյություն ունի 2 լ-իոն, l- ը պետք է լինի քառակուսային:
Փոխակերպել հավասարումները ՝ փոփոխականներ օգտագործելու համար: Վերաշարադրեք հավասարումը `օգտագործելով հանրահաշվական նորմալ մեթոդներ` օգտագործելով մոլեկուլների և իոնների քանակի մասին ձեր իմացած տեղեկատվությունը: Սահմանել x հավասար լուծույթի զանգվածին լուծարման համար և վերաշարադրել հավասարումը, որտեղ x ներկայացնում է յուրաքանչյուր իոնի քանակը:
- Այս օրինակում մենք պետք է վերաշարադրենք 7,1 × 10 = հավասարումը
- Քանի որ բաղադրության մեջ կա միայն մեկ կապարի իոն (Pb), լուծված մոլեկուլների քանակը հավասար է ազատ կապարի իոնների քանակին: Այսպիսով, մենք կարող ենք այն դնել x:
- Քանի որ յուրաքանչյուր կապարի իոնի համար կա յոդի երկու իոն (I), մենք յոդի ատոմների քանակը հավասար ենք 2x- ի:
- Այժմ հավասարումը դառնում է 7.1 × 10 = (x) (2x)
Հաշվի առեք սովորական իոնները, եթե այդպիսիք կան: Բաց թողեք այս քայլը, եթե լուծվում եք միացությունը թորած ջրի մեջ: Եթե մի բաղադրությունը լուծվում է լուծույթում, որն արդեն ունի մեկ կամ ավելի բաղադրիչ իոններ («ընդհանուր իոններ»), ապա միացության լուծելիությունը զգալիորեն կնվազի: Ընդհանուր իոնների ազդեցությունն առավել ակնհայտ կլինի գործնականում չլուծվող միացությունների վրա, և այս դեպքում կարող եք ենթադրել, որ հավասարակշռության տակ գտնվող իոնների մեծ մասը նախկինում լուծման մեջ գտնվողներն են: Վերաշարադրեք հավասարումը `լուծման մեջ արդեն պարունակվող իոնների մոլային կոնցենտրացիան (մոլ մեկ լիտրով կամ Մ) հաշվարկելու համար, այս արժեքը փոխարինելով այդ իոնի համար օգտագործվող x փոփոխականով:
- Օրինակ, եթե կապարի յոդի միացությունը լուծարվում է 0.2 Մ կապարի քլորիդ (PbCl) լուծույթում2), մենք հավասարումը կվերաշարադրենք որպես 7.1 × 10 = (0.2M + x) (2x): Քանի որ 0.2 Մ-ն ավելի բարձր կոնցենտրացիա է, քան x- ը, մենք կարող ենք այն վերաշարադրել 7.1 (10 = (0.2M) (2x):
Լուծիր հավասարումը: Լուծեք x- ի համար, և կտեսնեք բաղադրության լուծելիությունը: Լուծելիության հաստատունի սահմանման մեջ դուք պետք է գրեք ձեր պատասխանը մեկ լիտր ջրի մեջ լուծված միացության մոլերի քանակի առումով: Գուցե ստիպված լինեք համակարգիչ օգտագործել ՝ վերջնական պատասխանը գտնելու համար:
- Հաջորդ օրինակը թորած ջրի մեջ լուծելիությունն է ՝ առանց ընդհանուր իոնների:
- 7.1 × 10 = (x) (2x)
- 7.1 × 10 = (x) (4x)
- 7.1 × 10 = 4x
- (7,1 × 10) ÷ 4 = x
- x = ∛ ((7,1 × 10) ÷ 4)
- x = 1,2 x 10 մոլը մեկ լիտրի համար կլուծարվի, Սա շատ փոքր զանգված է, ուստի այս բաղադրությունը գրեթե անլուծելի է:
Ինչ է պետք
- Բաղադրության լուծելիության արտադրանքի հաստատունների աղյուսակ (Կսպ)
Խորհուրդներ
- Եթե ունեք փորձնական տվյալներ լուծված միացությունների քանակի վերաբերյալ, լուծելիության կայունության K- ի լուծման համար կարող եք օգտագործել նույն հավասարումը:սպ.
Arnգուշացում
- Այս տերմինների սահմանումների վերաբերյալ համաձայնություն չկա, բայց քիմիկոսները համաձայն են միացությունների մեծամասնության շուրջ: Մի շարք հատուկ միացություններ, որոնցում ինչպես լուծվող, այնպես էլ անլուծելի մոլեկուլները կազմում են զգալի բաղադրիչներ, որոնցից յուրաքանչյուրն ունի այս միացությունների տարբեր նկարագրություն:
- Որոշ հին դասագրքեր տեսնում են NH4OH- ը լուծվող միացություն է: Սա ճիշտ չէ; Հայտնաբերվել են փոքր քանակությամբ NH իոններ4 և OH, բայց այս երկու իոնները չեն կարող միավորվել միացությունների մեջ: