Հեղինակ:
Lewis Jackson
Ստեղծման Ամսաթիվը:
12 Մայիս 2021
Թարմացման Ամսաթիվը:
1 Հուլիս 2024
Բովանդակություն
Ատոմում նեյտրոնների քանակի որոշումը բավականին պարզ է, նույնիսկ անհրաժեշտ չէ որևէ փորձ կատարել: Նորմալ ատոմում կամ իզոտոպում նեյտրոնների քանակը հաշվարկելու համար պարզապես անհրաժեշտ է պատրաստել պարբերական աղյուսակ և հետևել հրահանգներին:
Քայլեր
2-ի մեթոդը 1. Գտեք նորմալ ատոմի նեյտրոնների քանակը
Որոշեք տարրի դիրքը պարբերական աղյուսակում: Օրինակ ՝ վերից վեցերորդ շարքում կգտնենք osmium (Os) տարրը:

Գտեք տարրի ատոմային թիվը: Սա ամենաակնառու թիվն է, որն անցնում է յուրաքանչյուր տարրի կողմից և գտնվում է պարզ խորհրդանիշից վեր (այն տախտակի վրա, որը մենք օգտագործում ենք, այլ թվեր չկան): Ատոմային թիվը այդ տարրի մեկ ատոմի պրոտոնների թիվն է, Os- ը 76 թիվն է, ինչը նշանակում է, որ օսմիումի ատոմում կա 76 պրոտոն:- Պրոտոնների քանակը երբեք չի փոխվում տարրի մեջ. դա ըստ էության տարրի որոշիչ բնութագիր է:

Գտեք տարրի ատոմային քաշը: Այս թիվը սովորաբար հանդիպում է պարզ խորհրդանիշի տակ: Նշենք, որ այս օրինակում պարբերական աղյուսակն ունի միայն ատոմային համար և չունի ատոմային քաշ: Ոչ բոլոր պարբերական աղյուսակները: Օսմիումի ատոմային քաշը կազմում է 190,23:
Ատոմային քաշը կլորացրեք մոտակա ամբողջ թվին ՝ ատոմային զանգվածը ստանալու համար: Օրինակ, 190.23-ը կլորացվի 190-ի, ուստի օսմիումի ատոմային զանգվածը 190 է:- Ատոմային քաշը նույն քիմիական տարրի իզոտոպների միջին ցուցանիշն է, այդ պատճառով էլ այն սովորաբար ամբողջ թիվ չէ:
Ատոմային զանգվածը հանել ատոմային զանգվածից: Քանի որ ատոմային զանգվածի մեծ մասը պրոտոնների և նեյտրոնների զանգված է, ատոմային զանգվածից հանելով պրոտոնների քանակը (այսինքն ՝ ատոմային համարը), հաշվել ստացեք ատոմի նեյտրոնների քանակը: Տասնորդական կետից հետո համարը ներկայացնում է ատոմի էլեկտրոնների շատ փոքր զանգվածը: Այս օրինակում մենք ունենք. 190 (զանգվածային ատոմ) - 76 (պրոտոնների քանակ) = 114 (նեյտրոնների քանակ):
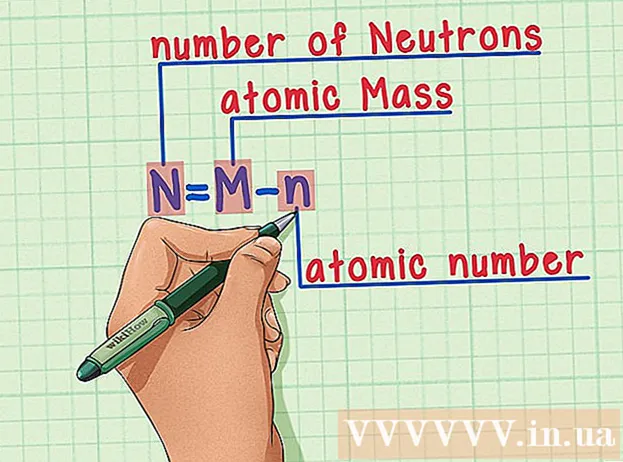
Անգիր բաղադրատոմսը: Նեյտրոնների քանակը գտնելու համար մենք պարզապես կիրառում ենք հետևյալ բանաձևը.
- N = M - n
- N = նեյտրոնների քանակը
- M = ատոմային զանգված
- n = ատոմային համար
- N = M - n
2-ի մեթոդը 2. Գտեք իզոտոպում նեյտրոնների քանակը
Որոշեք տարրի դիրքը պարբերական աղյուսակում: Որպես օրինակ վերցնենք ածխածնի -14 իզոտոպ տարրը: Քանի որ ածխածնի -14 իզոտոպային ձևը պարզապես ածխածին է (C), ապա ածխածին փնտրեք պարբերական համակարգի վրա (վերևից երկրորդ շարքը):
Գտեք տարրի ատոմային թիվը: Սա ամենաակնառու թիվն է, որն անցնում է յուրաքանչյուր տարրի կողմից և գտնվում է պարզ խորհրդանիշից վեր (այն տախտակի վրա, որը մենք օգտագործում ենք, այլ թվեր չկան): Ատոմային թիվը այդ տարրի մեկ ատոմի պրոտոնների թիվն է, C թիվը 6 է, ինչը նշանակում է, որ ածխածնի ատոմում կա 6 պրոտոն:
Գտեք ատոմային զանգված: Իզոտոպների դեպքում դա չափազանց հեշտ է, քանի որ դրանք անվանում են ատոմային զանգվածի անունով: Օրինակ ՝ ածխածն-14-ը կունենա 14 ատոմային զանգված
Ատոմային զանգվածը հանել ատոմային զանգվածից: Քանի որ ատոմային զանգվածի մեծ մասը պրոտոնների և նեյտրոնների զանգված է, ատոմային զանգվածից հանելով պրոտոնների քանակը (այսինքն ՝ ատոմային համարը), հաշվել ստացեք ատոմի նեյտրոնների քանակը: Տասնորդական կետից հետո համարը ներկայացնում է ատոմի էլեկտրոնների շատ փոքր զանգվածը: Այս օրինակում մենք ունենք. 14 (զանգվածային ատոմ) - 6 (պրոտոնների քանակ) = 8 (նեյտրոնների քանակ):
Անգիր բաղադրատոմսը: Նեյտրոնների քանակը գտնելու համար մենք կիրառում ենք հետևյալ բանաձևը.
- N = M - n
- N = նեյտրոնների քանակը
- M = ատոմային զանգված
- n = ատոմային համար
- N = M - n
Խորհուրդներ
- Տարրի զանգվածը հիմնականում պրոտոնների և նեյտրոնների զանգվածներն են, մինչդեռ էլեկտրոնների և այլ տարրերի զանգվածներն աննշան են (գրեթե զրոյական): Քանի որ պրոտոնի զանգվածը մոտավորապես հավասար է նեյտրոնի զանգվածին, իսկ ատոմային թիվը ներկայացնում է պրոտոնների քանակը, մենք ուղղակի պրոտոնների քանակը հանում ենք ընդհանուր զանգվածից:
- Եթե չեք հիշում պարբերական աղյուսակում թվերի նշանակությունը, հիշեք, որ պարբերական համակարգը սովորաբար կառուցվում է ատոմային թվերի վրա (այսինքն ՝ պրոտոնների քանակը), սկսած 1-ից (ջրածին) և ավելացնում է մեկ բառ ձախից աջ, ավարտվում է 118-ով (ununoctium): Քանի որ պրոտոնների քանակը յուրաքանչյուր ատոմի նույնականացման առանձնահատկությունն է, դա ամենապարզ հատկությունն է, որի վրա դասավորված են տարրերը: (Օրինակ ՝ 2 պրոտոն ունեցող ատոմը միշտ հելիում է, ինչպես 79 պրոտոն ունեցող ատոմը միշտ ոսկի է):
Աղբյուրները և մեջբերումները
- Ինտերակտիվ պարբերական աղյուսակ