Հեղինակ:
Lewis Jackson
Ստեղծման Ամսաթիվը:
12 Մայիս 2021
Թարմացման Ամսաթիվը:
1 Հուլիս 2024
Բովանդակություն
Էլեկտրոնի կազմաձեւում ատոմը էլեկտրոնային օրբիտալները ներկայացնող թվերի շարք է: Էլեկտրոն օբիտանները ատոմի միջուկը շրջապատող տարբեր ձևերի տարածական տարածքներ են, որոնցում էլեկտրոնները դասավորված են կարգավորված: Էլեկտրոնի կազմաձևի միջոցով դուք կարող եք արագ որոշել, թե քանի էլեկտրոնային ուղեծրեր կան ատոմում, և յուրաքանչյուր ուղեծրում էլեկտրոնների քանակը: Էլեկտրոնի կազմաձևման հիմնական սկզբունքները հասկանալուց հետո կկարողանաք գրել ձեր սեփական էլեկտրոնային կազմաձևը և վստահորեն կատարել քիմիական փորձարկումներ:
Քայլեր
2-ի մեթոդ 1. Որոշեք էլեկտրոնների քանակը ՝ օգտագործելով քիմիական պարբերական աղյուսակ
Գտեք ատոմի ատոմային թիվը: Յուրաքանչյուր ատոմ ունի իր հետ կապված որոշակի թվով էլեկտրոններ: Տեղադրեք տարրը պարբերական աղյուսակում: Ատոմային թիվը դրական ամբողջ թիվ է `սկսած 1-ից (ջրածնի համար) և դրանից հետո յուրաքանչյուր ատոմի համար ավելանալով 1-ով: Ատոմային թիվը ատոմի պրոտոնների թիվն է, այնպես որ դա նաև հիմքի վիճակում գտնվող ատոմի էլեկտրոնների քանակն է:
- Որոշեք ատոմի լիցքը: Էլեկտրականորեն չեզոք ատոմն ունի էլեկտրոնների ճիշտ քանակ, ինչպես ցույց է տրված պարբերական աղյուսակում: Այնուամենայնիվ, լիցքավորված ատոմը կունենա ավելի կամ պակաս էլեկտրոններ ՝ ելնելով իր լիցքի մեծությունից: Եթե դուք աշխատում եք լիցք ունեցող ատոմների հետ, ավելացրեք կամ հանեք համապատասխան քանակի էլեկտրոններ. Յուրաքանչյուր բացասական լիցքի համար ավելացրեք մեկ էլեկտրոն և յուրաքանչյուր դրական լիցքի համար հանեք մեկ էլեկտրոն:
- Օրինակ ՝ +1 լիցքավորմամբ նատրիումի ատոմը մեկ բազային էլեկտրոն կհեռացնի բազային ատոմային համարից 11: Հետևաբար, նատրիումի ատոմը կունենա ընդհանուր առմամբ 10 էլեկտրոն:
- Անգիր հիշիր հիմնական ուղեծրային ցուցակը: Երբ ատոմը ստանում է էլեկտրոններ, այդ էլեկտրոնները կկազմակերպվեն ուղեծրերի ՝ ըստ հատուկ կարգի: Երբ էլեկտրոնները լրացնում են օրբիտալները, յուրաքանչյուր ուղեծրում էլեկտրոնների քանակը հավասար է: Մենք ունենք հետևյալ օրբիտալները.
- Օբիտան ս (էլեկտրոնային կազմաձևում «s» - ով հետևյալ ցանկացած թիվ) ունի միայն մեկ ուղեծիր և հետևիր Սկզբունքը, բացառությամբ ՊաուլիիՅուրաքանչյուր ուղեծր պարունակում է առավելագույնը 2 էլեկտրոն, այնպես որ յուրաքանչյուր s ուղեծրը պարունակում է ընդամենը 2 էլեկտրոն:
- Օբիտան պ ունի 3 օրբիտալ, ուստի այն կարող է պահել 6 էլեկտրոն:
- Օբիտան դ ունի 5 օրբիտալ, ուստի այն կարող է պահել մինչև 10 էլեկտրոն:
- Օբիտան զ ունի 7 օրբիտալ, ուստի կարող է պահել մինչև 14 էլեկտրոն: Անգիր հիշիր ուղեծրերի կարգը ըստ հետևյալ գրավիչ նախադասության.
Սվրա Պագրեսիվ Դվայ ՖԼավ Գթմրած ՀՎայ ÍԿԵս գալիս եմ.
Ավելի շատ էլեկտրոն ունեցող ատոմների համար օրբիտալները շարունակում են այբբենական կարգով գրել k տառից հետո ՝ դուրս թողնելով օգտագործված նիշերը:
- Հասկանալ էլեկտրոնի կազմաձևը: Էլեկտրոնային կազմաձևերը գրված են հստակ ցույց տալու համար ատոմի էլեկտրոնների քանակը, ինչպես նաև էլեկտրոնների քանակը յուրաքանչյուր ուղեծրում: Յուրաքանչյուր ուղեծիր գրված է որոշակի հերթականությամբ, յուրաքանչյուր ուղեծրում էլեկտրոնների քանակը գրված է ուղեծրի անվան աջից վեր: Վերջապես էլեկտրոնի կազմաձևումը հաջորդականություն է, որը բաղկացած է օրբիտալների անուններից և դրանց աջ կողմում վերևում գրված էլեկտրոնների քանակից:
- Հաջորդ օրինակը էլեկտրոնի պարզ կազմաձև է. 1s 2s 2p, Այս կազմաձևը ցույց է տալիս, որ 1s ուղեծրում կա երկու էլեկտրոն, 2s ուղեծրում ՝ երկու էլեկտրոն, և 2p ուղեծրում ՝ վեց էլեկտրոն: 2 + 2 + 6 = 10 էլեկտրոն (ընդհանուր): Այս էլեկտրոնային կազմաձեւը էլեկտրականորեն չեզոք նեոնի ատոմի համար է (նեոնի ատոմային թիվը 10 է):
- Անգիր սովորել օրբիտալների կարգը: Նկատենք, որ ուղեծրերը համարակալված են ըստ էլեկտրոնների դասի, բայց էներգետիկորեն դասավորված են: Օրինակ, 4s ուղեծրը հագեցած է ավելի ցածր էներգիայի (կամ ավելի դիմացկուն) քան հագեցած կամ չհագեցած 3d ուղեծրից, ուստի նախ գրվում է 4s ենթադասը: Ուղեծրերի կարգը իմանալուց հետո կարող եք դրանց մեջ էլեկտրոնները դասավորել ըստ ատոմի էլեկտրոնների քանակի: Էլեկտրոնները օրբիտալների մեջ տեղադրելու կարգը հետևյալն է. 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p, 8s.
- Ատոմի էլեկտրոնային կազմաձեւը յուրաքանչյուր էլեկտրոնով լի ուղեծրով գրված է այսպես. 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d7p
- Նկատի ունեցեք, որ եթե բոլոր շերտերը լրացված են, վերը նշված էլեկտրոնային կազմաձևը Og- ի (Oganesson) 118-ն է, որը պարբերական աղյուսակի ամենաբարձր համարակալված ատոմն է. Պարունակում է ներկայումս հայտնի բոլոր էլեկտրոնային շերտերը էլեկտրականորեն չեզոք ատոմով:
- Էլեկտրոնները դասավորեք ուղեծրերի ՝ ըստ ատոմի էլեկտրոնների քանակի: Օրինակ, եթե ցանկանում եք գրել էլեկտրական չեզոք կալցիումի ատոմի էլեկտրոնային կազմաձևը, առաջին բանը, որ պետք է անեք, պարբերական աղյուսակում գտնել դրա ատոմային համարն է: Կալցիումի ատոմային թիվը 20 է, ուստի մենք 20 էլեկտրոն ունեցող ատոմի կազմաձևը կգրենք վերը նշված հերթականությամբ:
- Տեղադրեք ձեր էլեկտրոնները ուղեծրերի մեջ վերևի հերթականությամբ, մինչև հասնեք 20 էլեկտրոնների: Օբիտան 1-ը ստանում է երկու էլեկտրոն, 2-ը `երկու, 2-ը` վեց, 3-ը `երկու, 3-ը` վեց, իսկ 4-ը `երկու (2 + 2 + 6 +2 +6 + 2 = 20): Հետևաբար, կալցիի էլեկտրոնային կազմաձևը հետևյալն է. 1s 2s 2p 3s 3p 4s.
- Նշում. Էլեկտրոնի շերտի ավելացման հետ մեկտեղ էներգիայի մակարդակը փոխվում է: Օրինակ, երբ գրում եք 4-րդ էներգիայի մակարդակին, նախ գրվում է 4s ենթադասը, ավելի ուշ 3d- ով: Չորրորդ էներգիայի մակարդակը գրելուց հետո դուք կանցնեք հինգերորդ մակարդակ և կրկին կսկսեք շերտավորման կարգը: Դա տեղի է ունենում միայն 3-րդ էներգիայի մակարդակից հետո:
- Օգտագործեք պարբերական աղյուսակը որպես տեսողական դյուրանցում: Հնարավոր է ՝ նկատել եք, որ պարբերական համակարգի ձևը համապատասխանում է էլեկտրոնների կազմաձևում օրբիտալների կարգին: Օրինակ ՝ երկրորդ ձախ սյունակում գտնվող ատոմները միշտ ավարտվում են «s» - ով, միջին հատվածի ծայր աջ կողմում գտնվող ատոմները միշտ ավարտվում են «d» - ով և այլն: Կառուցվածքներ գրելու համար օգտագործիր պարբերական աղյուսակը: գործիչ - էլեկտրոնները ուղեծրերի մեջ տեղադրելու կարգը կհամապատասխանի պարբերական աղյուսակում ցուցադրված դիրքերին: Տես ներքեւում:
- Երկու ձախ սյունները ատոմներ են, որոնց էլեկտրոնային կազմաձևը ավարտվում է s ուղեծրով, պարբերական համակարգի աջ մասը ատոմներ են, որոնց էլեկտրոնային կազմաձևը ավարտվում է p ուղեծրով, միջին մասը ատոմներ են, որոնք ավարտվում են s ուղեծրով: d, իսկ ներքևում են այն ատոմները, որոնք ավարտվում են f ուղեծրով:
- Օրինակ ՝ քլորի տարրի էլեկտրոնային կազմաձևը գրելիս բերեք հետևյալ փաստարկը. Այս ատոմը գտնվում է պարբերական համակարգի երրորդ շարքում (կամ «ժամանակահատվածում»): Այն գտնվում է նաև պարբերական համակարգի p ուղեծրային բլոկի հինգերորդ սյունակում: Այսպիսով, էլեկտրոնի կազմաձեւը կավարտվի ... 3p.
- Fulգույշ Պարբերական համակարգի d և f ուղեծրերի դասերը համապատասխանում են իրենց ժամանակաշրջանից տարբերվող էներգիայի մակարդակներին: Օրինակ, d ուղեծրային բլոկի առաջին շարքը համապատասխանում է 3d ուղեծրին, չնայած այն գտնվում է 4-րդ շրջանում, մինչդեռ f ուղեծրի առաջին շարքը համապատասխանում է 4f ուղեծրին, չնայած այն գտնվում է 6-րդ շրջանում:
- Իմացեք, թե ինչպես գրել փչացող էլեկտրոնային կազմաձևեր: Պարբերական համակարգի աջ եզրին գտնվող ատոմները կոչվում են հազվագյուտ գազ, Այս տարրերը քիմիապես շատ իներտ են: Էլեկտրոնի երկար կոնֆիգուրացիան կրճատելու համար քառակուսի փակագծերում գրիր մոտակա հազվագյուտ գազի քիմիական խորհրդանիշը, որն ունի ավելի քիչ էլեկտրոններ, քան ատոմի, և ապա շարունակիր գրել հաջորդ ուղեծրերի էլեկտրոնային կազմաձևերը: , Տես ներքեւում:
- Այս հասկացությունը հասկանալու համար գրեք օրինակով փլուզված էլեկտրոնային կազմաձևը: Ենթադրենք, որ հազվագյուտ գազի կազմաձևի միջոցով անհրաժեշտ է գրել էլեկտրոնի կազմաձևը ցինկի կրճատման համար (ատոմային թիվ 30): Zինկի էլեկտրոնի ամբողջական կազմաձեւը `1s 2s 2p 3s 3p 4s 3d. Այնուամենայնիվ, նշենք, որ 1s 2s 2p 3s 3p հազվագյուտ ագոնիկ գազի կազմաձևն է: Ուղղակի փոխարինեք ցինկի էլեկտրոնային նշագրման այս մասը քառակուսի փակագծերում գտնվող ագոնիկ քիմիական խորհրդանիշով ():
- Ուստի ցինկի էլեկտրոնային կազմաձեւումը կոմպակտ է 4s 3d.
2-ի մեթոդը 2. Օգտագործելով ADOMAH պարբերական աղյուսակ

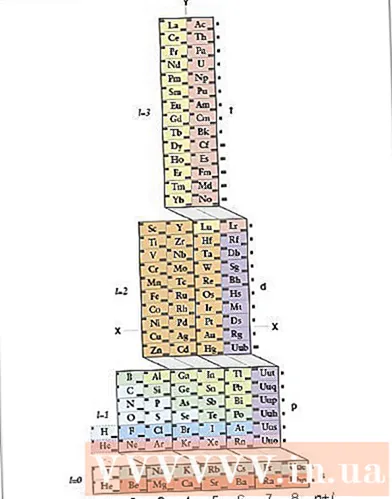
Ուսումնասիրեք ADOMAH պարբերական աղյուսակը: Էլեկտրոնի կազմաձևը գրելու այս մեթոդը չի պահանջում անգիր: Այնուամենայնիվ, այս մեթոդը պահանջում է վերադասավորված պարբերական աղյուսակ, քանի որ կանոնավոր պարբերական աղյուսակում, չորրորդ շարքից սկսած, ցիկլերի քանակը չի համապատասխանում էլեկտրոնային շերտին: Գտեք ADOMAH պարբերական աղյուսակ, հատուկ քիմիական պարբերական աղյուսակ, որը մշակվել է գիտնական Վալերի imիմմերմանի կողմից: Այս պարբերական աղյուսակը կարող եք գտնել ինտերնետում:- ADOMAH պարբերական աղյուսակում հորիզոնական շարքերը տարրերի խմբեր են, ինչպիսիք են հալոգենները, իներտ գազերը, ալկալային մետաղները, ալկալային հողային մետաղները և այլն: Ուղղահայաց սյունները համապատասխանում են էլեկտրոնային շերտին և կոչվում են «աստիճաններ» (անկյունագծային գծեր): s, p, d և f բլոկները համապատասխանում են ժամանակահատվածին:
- Հելիումը դասավորված է ջրածնի կողքին, քանի որ երկուսն էլ ունեն յուրահատուկ 1s ուղեծր: Պարբերական բլոկները (ներ, պ, դ և զ) ցուցադրվում են աջ կողմում, իսկ հիմքում ՝ էլեկտրոնային շերտերի քանակը: Տարրերի անունները գրված են 1-ից 120 համարի ուղղանկյան մեջ: Այս թվերը սովորական ատոմային թվեր են, որոնք ներկայացնում են էլեկտրոնային չեզոք ատոմի էլեկտրոնների ընդհանուր քանակը:
- Գտեք տարրեր պարբերական աղյուսակում ADOMAH: Էլեմոնի էլեկտրոնային կազմաձև գրելու համար տեղադրեք դրա խորհրդանիշը ADOMAH պարբերական աղյուսակում և գծանշեք ավելի բարձր ատոմային թվերով բոլոր տարրերը: Օրինակ, եթե ուզում եք գրել eribi- ի էլեկտրոնային կազմաձևը (68), հատեք 69-ից 120-ի տարրերը:
- Նշեք պարբերական աղյուսակի հիմքում գտնվող 1-ից 8 թվերը: Սա էլեկտրոնային շերտերի կամ սյունների քանակն է: Ուշադրություն մի դարձրեք սյուններին, որոնք հատել են միայն տարրերը:Eribi- ի համար մնացած սյունները 1, 2, 3, 4, 5 և 6 են:
- Հաշվեք օրբիտալների քանակը ատոմի դիրքի վրա ՝ կազմաձևը գրելու համար: Նայեք պարբերական աղյուսակի (s, p, d և f) աջ կողմում ցույց տրված բլոկային նշմանը և նայեք սեղանի հիմքում ցույց տրված սյունակների քանակին ՝ անկախ բլոկների անկյունագծից, սյունը բաժանեք սյունների բլոկների և գրեք դրանք կարգի են ներքևից վերև: Անտեսեք սյունաշարերի բլոկները, որոնք պարունակում են միայն գծանշված տարրեր: Գրեք սյունակի բլոկները ՝ սկսած սյունակի համարից, իսկ այնուհետև բլոկի խորհրդանիշից, այսպես ՝ 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s (eribi- ի դեպքում):
- Նշում. Er- ի վերը նշված էլեկտրոնային կազմաձևը գրված է էլեկտրոնային շերտերի քանակի աճման կարգով: Այս կազմաձևը կարող է գրվել նաև էլեկտրոնները օրբիտալների մեջ տեղադրելու կարգով: Սյունակներ-բլոկներ գրելիս սյունակների փոխարեն հետևեք քայլերին վերևից ներքև. 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f:
- Հաշվեք էլեկտրոնների քանակը մեկ ուղեծրով: Հաշվեք յուրաքանչյուր սյուն-բլոկում խաչված էլեկտրոնների քանակը, յուրաքանչյուր տարրի համար նշանակեք մեկ էլեկտրոն և յուրաքանչյուր բլոկ-սյունակի համար բլոկի խորհրդանիշի կողքին գրեք էլեկտրոնների քանակը `1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6-ականներ Այս օրինակում սա eribi- ի էլեկտրոնային կազմաձևն է:
- Recանաչել աննորմալ էլեկտրոնային կազմաձևերը: Ամենացածր էներգետիկ վիճակում գտնվող ատոմների էլեկտրոնային կազմաձևում կա տասնութ ընդհանուր բացառություն, որը հայտնի է նաև որպես հիմք: Համեմատության ընդհանուր կանոնի հետ, նրանք միայն շեղվում են վերջին երկու-երեք էլեկտրոնային դիրքերից: Այս դեպքում էլեկտրոնների իրական կազմաձևը առաջացնում է էլեկտրոնների էներգիայի ավելի ցածր վիճակ, քան ատոմի ստանդարտ կազմաձևը: Արտասովոր ատոմներն են.
- Քր (..., 3d5, 4s1); Cu (..., 3d10, 4s1); Nb (..., 4d4, 5s1); Մո (..., 4d5, 5s1); Ռու (..., 4d7, 5s1); Rh (..., 4d8, 5s1); Pd (..., 4d10, 5s0); Ագ (..., 4d10, 5s1); Լա (..., 5d1, 6s2); Մ.թ.ա. (..., 4f1, 5d1, 6s2); Gd (..., 4f7, 5d1, 6s2); Աու (..., 5d10, 6s1); Ակ (..., 6d1, 7s2); Թ (..., 6d2, 7s2); Պա (..., 5f2, 6d1, 7s2); Ու (..., 5f3, 6d1, 7s2); Np (..., 5f4, 6d1, 7s2) և Սմ (..., 5f7, 6d1, 7s2):
Խորհուրդներ
- Երբ ատոմը իոն է, դա նշանակում է, որ պրոտոնների քանակը հավասար չէ էլեկտրոնների քանակին: Դրանից հետո ատոմի լիցքը ցուցադրվում է տարրի խորհրդանիշի (սովորաբար) վերին աջ անկյունում: Ուստի +2 լիցքավորմամբ անտիմոնի ատոմը կունենա 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p էլեկտրոնի կազմաձև: Նշենք, որ 5p- ը փոխվում է 5p- ի: Ուշադիր եղեք, երբ էլեկտրականորեն չեզոք ատոմի կազմաձեւն ավարտվում է s- ից և p- ից բացի այլ ուղեծրերով, Էլեկտրոնների հեռացման դեպքում դուք կարող եք էլեկտրոններ վերցնել միայն վալենտային օրբիտալներից (ներ և պ ուղեծրերից): Այսպիսով, եթե կազմաձևերն ավարտվում են 4s 3d- ով, և ատոմի լիցքը +2 է, կազմաձևը փոխվում է 4s 3d: Մենք տեսնում ենք 3Dհաստատուն, բայց s- ի ուղեծրից հանվում են միայն էլեկտրոնները:
- Բոլոր ատոմները հակված են վերադառնալ կայուն վիճակի, և ամենակայուն էլեկտրոնային կազմաձևը կունենա բավարար s և p ուղեծրեր (s2 և p6): Այս հազվագյուտ գազերն ունեն այս էլեկտրոնային կազմաձեւը, այդ պատճառով նրանք հազվադեպ են մասնակցում ռեակցիաների և գտնվում են պարբերական համակարգի աջ կողմում: Այսպիսով, եթե կազմաձևն ավարտվում է 3p- ով, ապա կայունության համար անհրաժեշտ է ընդամենը երկու էլեկտրոն (վեց էլեկտրոն տալը, ներառյալ ուղեծրի էլեկտրոնները, ավելի շատ էներգիա կպահանջի, այնպես որ չորս էլեկտրոն տալը ավելի հեշտ կլինի: ավելի հեշտ): Եթե կազմաձևն ավարտվում է 4 d- ով, ապա կայուն վիճակին հասնելու համար անհրաժեշտ է միայն տալ երեք էլեկտրոն: Նմանապես, նոր ենթադասերը, որոնք ստանում են էլեկտրոնների կեսը (s1, p3, d5 ..), ավելի կայուն են, օրինակ ՝ p4 կամ p2, բայց s2 և p6 էլ ավելի կայուն կլինեն:
- Կարող եք նաև օգտագործել վալենտային էլեկտրոնի կազմաձևը ՝ գրելու համար մի տարրի էլեկտրոնային կազմաձևը, որը վերջին s և p օրբիտալներն են: Հետևաբար, անտիմոնի ատոմի վալենտային կազմաձևը 5s 5p է:
- Իոններին դա դուր չի գալիս, քանի որ դրանք շատ ավելի դիմացկուն են: Բաց թողեք սույն հոդվածի վերը նշված երկու քայլերը և աշխատեք նույն կերպ ՝ կախված նրանից, թե որտեղ եք սկսում և քանի կամ պակաս էլեկտրոն ունեք:
- Ատոմային համարը իր էլեկտրոնային կազմաձևից գտնելու համար ավելացրեք բոլոր թվերը, որոնք հետևում են տառերին (s, p, d և f): Դա ճիշտ է միայն այն դեպքում, եթե դա չեզոք ատոմ է, եթե դա իոն է, ապա դուք չեք կարող օգտագործել այս մեթոդը: Փոխարենը, դուք պետք է ավելացնեք կամ հանեք այն էլեկտրոնների քանակը, որոնք վերցնում եք կամ տալիս եք:
- Տառին հաջորդող համարը պետք է գրված լինի աջ վերին անկյունում, քննությունը հանձնելիս չպետք է սխալ գրեք:
- Էլեկտրոնային կազմաձևեր գրելու երկու տարբեր եղանակ կա: Կարող եք գրել էլեկտրոնային շերտի աճման կարգով կամ էլեկտրոնները ուղեծրերի մեջ տեղադրելու կարգով, ինչպես ցույց է տրված eribi ատոմի համար:
- Կան դեպքեր, երբ էլեկտրոնը պետք է «մղվի»: Դա այն դեպքում, երբ ուղեծրին բացակայում է միայն մեկ էլեկտրոն, որպեսզի ունենա կեսը կամ ամբողջ էլեկտրոնը, ապա դուք պետք է էլեկտրոն վերցնեք մոտակա s կամ p ուղեծրից, որպեսզի այն փոխանցեք այդ էլեկտրոնի կարիքն ունեցող ուղեծրին:
- Չենք կարող ասել, որ ենթադասի «էներգիայի կոտորակի կայունությունը» ստանում է էլեկտրոնների կեսը: Դա չափազանց պարզեցում է: «Ելեկտրոնների քանակի կեսը» ստացող նոր ենթադասի կայուն էներգիայի մակարդակի պատճառն այն է, որ յուրաքանչյուր ուղեծր ունի միայն մեկ առանձին էլեկտրոն, ուստի էլեկտրոն-էլեկտրոն վանելը նվազագույնի է հասցվում: