Հեղինակ:
Louise Ward
Ստեղծման Ամսաթիվը:
11 Փետրվար 2021
Թարմացման Ամսաթիվը:
1 Հուլիս 2024

Բովանդակություն
Ատոմի չափն այնքան փոքր է, որ դժվար է ճշգրիտ չափել քիմիական միացության ատոմային թիվը: Որպեսզի կարողանան ճշգրիտ չափել մի շարք նյութեր, գիտնականները օգտագործում են մոլի միավոր ՝ նշված քանակի ատոմների ներկայացման համար: Նյութի մեկ մոլը սահմանվում է որպես համարժեք ածխածնի ատոմների քանակին, որը պարունակվում է 12 ածխածնի իզոտոպի 12 գրամում, ինչը կազմում է մոտ 6,022 x 10 ատոմ: Այս արժեքը կոչվում է Ավոգադրոյի թիվ, կամ Ավոգադրոյի հաստատուն: Սա նաև կոչվում է որպես ցանկացած տարրի 1 մոլում ատոմների քանակ, իսկ նյութի զանգվածի 1 մոլը կոչվում է այդ նյութի մոլային զանգված:
Քայլեր
2-ի մեթոդը 1. Հաշվիր տարրի մոլային զանգվածը
Մոլային զանգվածի սահմանում: Նյութի մոլային զանգվածը այդ նյութի մեկ մոլի զանգվածն է (գրամներով): Էլեմենտի մոլային զանգվածը հաշվարկելու համար դրա ատոմային զանգվածը բազմապատկիր գրամ-մոլ փոխակերպման գործակցով (գ / մոլ):
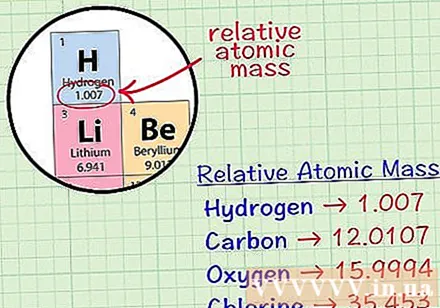
Գտեք տարրի միջին խորանարդ ատոմը: Տարրի միջին զանգվածի ատոմը միջին զանգվածն է, ատոմային միավորներով, նմուշում, որն ընդգրկում է այդ տարրի բոլոր իզոտոպները: Այս տեղեկատվությունը հաճախ տրվում է տարրերի պարբերական աղյուսակում: Տեղորոշելով տարր, դուք կարող եք գտնել միջին խորանարդ ատոմ, որը գրված է տարրի քիմիական խորհրդանիշի տակ: Այս արժեքը ամբողջ թիվ չէ, այլ տասնորդական թվեր:- Օրինակ, ջրածնի հետ միջին զանգվածային ատոմը 1.007 է. Ածխածնի միջին խորանարդ ատոմը 12,0107 է; Թթվածնի միջին զանգվածային ատոմը 15,9994 է; քլորի միջին ատոմային զանգվածը 35,453 է:

Բազմապատկել միջին զանգվածի ատոմը մոլային զանգվածի հաստատունով: Մոլային սահքի միավորը սահմանվում է որպես 0.001 կիլոգրամ մեկ մոլ, կամ 1 գրամ մեկ մոլ: Միջին զանգվածի ատոմի և մոլային զանգվածի հաստատունի արտադրանքը ատոմային զանգվածի միավորը վերափոխում է մեկ գրի վրա գրամի, ուստի ջրածնի մոլային զանգվածը կկազմի 1.007 գրամ մեկ մոլում, ածխածինը ՝ 12: , 0107 գրամ մեկ խլուրդի համար, թթվածինը 15,9995 գրամ է մոլի համար, իսկ քլորիինը ՝ 35,453 գրամ մեկ խլուրդի համար:- Որոշ տարրեր բնության մեջ գոյություն ունեն որպես մոլեկուլներ, որոնք բաղկացած են երկու կամ ավելի նույն ատոմներից: Այսինքն, եթե ուզում եք հաշվարկել ավելի քան մեկ ատոմից բաղկացած միացությունների մոլային զանգված, ինչպիսիք են ջրածնի գազը, թթվածնային գազը կամ քլորի գազը, ապա պետք է որոշեք բաղադրության միջին ատոմային զանգվածը և բազմապատկեք այս արժեքը: մոլային զանգվածի հաստատունով, «հետո» ՝ բազմապատկիր քո գտած արտադրանքը 2-ով:
- Հ2՝ 1,007 x 2 = 2,014 գրամ մեկ մոլ; O- ի համար2՝ 15,9994 x 2 = 31,9988 գրամ մեկ մոլ; և Cl235,453 x 2 = 70,096 գրամ մեկ մոլ:
2-ի մեթոդ 2. Հաշվիր միացության մոլային զանգվածը

Որոշեք բաղադրության կառուցվածքային բանաձեւը: Նյութի կառուցվածքային բանաձեւը տալիս է այդ բաղադրությունը կազմող յուրաքանչյուր տարրի ատոմային թիվը: (Այս տեղեկատվությունը հասանելի է բոլոր տեղեկատու գրքերում): Օրինակ, հիդրոքլորային թթվի քիմիական բանաձևը HCl է. գլյուկոզի C է6Հ12Ո6, Այս կառուցվածքային բանաձևով մենք կարող ենք որոշել քննարկվող միացությունը կազմող յուրաքանչյուր տեսակի ատոմի քանակը:- Որտեղ HCl- ն ունի մեկ ջրածնի ատոմ և մեկ քլորի ատոմ:
- Գլյուկոզայի շաքարի մոլեկուլ C6Հ12Ո6 ունի 6 ածխածնի ատոմ, 12 ջրածնի ատոմ և 6 թթվածնի ատոմ:
Որոշեք յուրաքանչյուր բաղադրիչ տարրի միջին զանգվածի ատոմը: Օգտագործեք պարբերական աղյուսակ ՝ բաղադրության մեջ առկա յուրաքանչյուր տարրի միջին զանգվածի ատոմը գտնելու համար: Միջին զանգվածային ատոմը սովորաբար գրվում է տարրի քիմիական խորհրդանիշի տակ ՝ պարբերական համակարգի վրա: Նման է տարրերի մոլային զանգվածը հաշվարկելուն, միջին զանգվածի ատոմը բազմապատկել 1 գրամ / մոլով:
- Աղաթթուն կազմող տարրերի միջին զանգվածային ատոմը հետևյալն է. Ջրածին 1,007 գ / մոլ և քլոր 35,453 գ / մոլ:
- Գլյուկոզայի մոլեկուլը կազմող տարրերի միջին զանգվածային ատոմը `ածխածին, 12,017 գ / մոլ; ջրածին, 1,007 գ / մոլ; և թթվածին ՝ 15,995 գ / մոլ:
Հաշվեք յուրաքանչյուր տարրի մոլային զանգվածը: Բազմապատկելով տարրի զանգվածի ատոմը `միացության մեջ ներգրավված ատոմների քանակով, տալիս է տարրի միջին զանգվածը բաղադրության մեջ:
- Աղաթթվի, HCl- ի դեպքում ջրածնի տարրի մոլային զանգվածը կազմում է 1,007 գ / մոլ, իսկ քլորիինը `35,453 գ / մոլ:
- Գլյուկոզի դեպքում ՝ C6Հ12Ո6, յուրաքանչյուր տարրի մոլային զանգվածը հետևյալն է. ածխածին, 12,0107 x 6 = 72,0642 գ / մոլ; ջրածին, 1,007 x 12 = 12,084 գ / մոլ; թթվածին, 15,9995 x 6 = 95,9964 գ / մոլ:
Բաղադրիչ տարրերի ընդհանուր մոլային զանգվածը: Կոմպոստացման տարրերի ընդհանուր մոլային զանգվածը միացության մոլային զանգված է:Նախորդ քայլում մենք հաշվարկել ենք բաղադրության մեջ առկա յուրաքանչյուր տարրի մոլային զանգվածը, այս քայլում պարզապես անհրաժեշտ է ավելացնել այս բոլոր արժեքները միասին:
- Աղաթթվի մոլային զանգվածը կազմում է 1,007 + 35,453 = 36,460 գ / մոլ: 36,46 գրամը 1 մոլ աղաթթվի զանգվածն է:
- Գլյուկոզի մոլային զանգվածը 72,0642 + 12,084 + 95,9964 = 180,1446 գ / մոլ է: Այսպիսով, յուրաքանչյուր մոլ գլյուկոզայի զանգվածը կազմում է 180,14 գրամ:
Խորհուրդներ
- Չնայած շատ դեպքերում միջին զանգվածի ատոմը գրանցվում է մոտավորապես 1 մաս 1000 (4 տասնորդական կետ), լաբորատորիաներում մոլային զանգվածը հաճախ իջեցվում է մինչև 2 տասնորդական, երբեմն նույնիսկ ավելի քիչ, մեծ մոլեկուլների համար: Ուստի, լաբորատոր դեպքում, հիդրոքլորային թթվի մոլային զանգվածը կարող է գրվել որպես 36,46 գրամ մեկ մոլ, գլյուկոզի համար ՝ 180,14 գրամ մեկ մոլ:
Ինչ է պետք
- Քիմիական տեղեկատու գիրք կամ տարրերի պարբերական աղյուսակ
- Համակարգիչ



