Հեղինակ:
Eric Farmer
Ստեղծման Ամսաթիվը:
10 Մարտ 2021
Թարմացման Ամսաթիվը:
1 Հուլիս 2024
Բովանդակություն
- Քայլեր
- Մեթոդ 1 -ից 2 -ը. Ատոմներում նեյտրոնների քանակի որոշում (ոչ իզոտոպներ)
- Մեթոդ 2 -ից 2 -ը. Իզոտոպներում նեյտրոնների թվի որոշում
- Խորհուրդներ
Նույն տարրի ատոմներում պրոտոնների թիվը հաստատուն է, մինչդեռ նեյտրոնների թիվը կարող է տարբեր լինել: Իմանալով, թե քանի նեյտրոն է պարունակում որոշակի ատոմ, դուք կարող եք որոշել ՝ դա սովորական ատոմ է, թե՞ իզոտոպ, որը կունենա ավելի քիչ կամ ավելի շատ նեյտրոններ: Ատոմում նեյտրոնների քանակի որոշումը բավականին պարզ է: Ատոմում կամ իզոտոպում նեյտրոնների քանակը հաշվարկելու համար անհրաժեշտ է միայն հետևել մեր հրահանգներին և պարբերական համակարգին ձեռքի տակ պահել:
Քայլեր
Մեթոդ 1 -ից 2 -ը. Ատոմներում նեյտրոնների քանակի որոշում (ոչ իզոտոպներ)
 1 Գտեք պարբերական աղյուսակի տարրը: Որպես օրինակ, մենք կդիտարկենք osmium (Os), որը գտնվում է վեցերորդ շրջանում (վերևից վեցերորդ շարքում):
1 Գտեք պարբերական աղյուսակի տարրը: Որպես օրինակ, մենք կդիտարկենք osmium (Os), որը գտնվում է վեցերորդ շրջանում (վերևից վեցերորդ շարքում):  2 Գտեք տարրի ատոմային թիվը: Սա, որպես կանոն, տարրի բջիջի ամենանշանակալի թիվն է և սովորաբար գտնվում է դրա խորհրդանիշից վեր (պարբերական համակարգի տարբերակում, որը մենք օգտագործում ենք մեր օրինակում, այլ թվեր չկան): Ատոմային համարը այդ տարրի մեկ ատոմի պրոտոնների քանակն է: Օսմիումի համար այս թիվը 76 է, այսինքն մեկ օսմիումի ատոմում կա 76 պրոտոն:
2 Գտեք տարրի ատոմային թիվը: Սա, որպես կանոն, տարրի բջիջի ամենանշանակալի թիվն է և սովորաբար գտնվում է դրա խորհրդանիշից վեր (պարբերական համակարգի տարբերակում, որը մենք օգտագործում ենք մեր օրինակում, այլ թվեր չկան): Ատոմային համարը այդ տարրի մեկ ատոմի պրոտոնների քանակն է: Օսմիումի համար այս թիվը 76 է, այսինքն մեկ օսմիումի ատոմում կա 76 պրոտոն: - Պրոտոնների թիվը անփոփոխ է, և դա այն է, ինչը տարրը դարձնում է տարր:
 3 Գտեք տարրի ատոմային զանգվածը: Այս թիվը սովորաբար գտնվում է տարրի խորհրդանիշից ներքև: Խնդրում ենք նկատի ունենալ, որ մեր օրինակի պարբերական համակարգի տարբերակում ատոմային զանգվածը տրված չէ (դա միշտ չէ, որ լինում է. Պարբերական համակարգի բազմաթիվ տարբերակներում նշվում է ատոմային զանգվածը): Օսմիումի ատոմային զանգվածը 190,23 է:
3 Գտեք տարրի ատոմային զանգվածը: Այս թիվը սովորաբար գտնվում է տարրի խորհրդանիշից ներքև: Խնդրում ենք նկատի ունենալ, որ մեր օրինակի պարբերական համակարգի տարբերակում ատոմային զանգվածը տրված չէ (դա միշտ չէ, որ լինում է. Պարբերական համակարգի բազմաթիվ տարբերակներում նշվում է ատոմային զանգվածը): Օսմիումի ատոմային զանգվածը 190,23 է:  4 Կլորացրեք ատոմային զանգվածը մինչև ամբողջ ամբողջական թիվը: Մեր օրինակում 190.23 -ը կլորացվում է 190 -ի:
4 Կլորացրեք ատոմային զանգվածը մինչև ամբողջ ամբողջական թիվը: Մեր օրինակում 190.23 -ը կլորացվում է 190 -ի: - Ատոմային զանգվածը որոշակի տարրի իզոտոպների միջին թիվն է, սովորաբար այն չի արտահայտվում որպես ամբողջ թիվ:
 5 Ատոմային զանգվածից հանեք ատոմային թիվը: Քանի որ պրոտոններն ու նեյտրոնները կազմում են ատոմային զանգվածի բացարձակ մասը, ապա ատոմային զանգվածից հանելով պրոտոնների թիվը (այսինքն ՝ ատոմային թիվը, որը հավասար է պրոտոնների քանակին) տալիս է ատոմի նեյտրոնների թիվը: Տասնորդական կետից հետո թվերը վերաբերում են ատոմի էլեկտրոնների շատ փոքր զանգվածին: Մեր օրինակում `190 (ատոմային քաշ) - 76 (պրոտոնների քանակ) = 114 (նեյտրոնների քանակ):
5 Ատոմային զանգվածից հանեք ատոմային թիվը: Քանի որ պրոտոններն ու նեյտրոնները կազմում են ատոմային զանգվածի բացարձակ մասը, ապա ատոմային զանգվածից հանելով պրոտոնների թիվը (այսինքն ՝ ատոմային թիվը, որը հավասար է պրոտոնների քանակին) տալիս է ատոմի նեյտրոնների թիվը: Տասնորդական կետից հետո թվերը վերաբերում են ատոմի էլեկտրոնների շատ փոքր զանգվածին: Մեր օրինակում `190 (ատոմային քաշ) - 76 (պրոտոնների քանակ) = 114 (նեյտրոնների քանակ):  6 Հիշեք բանաձևը. Ապագայում նեյտրոնների թիվը գտնելու համար պարզապես օգտագործեք այս բանաձևը.
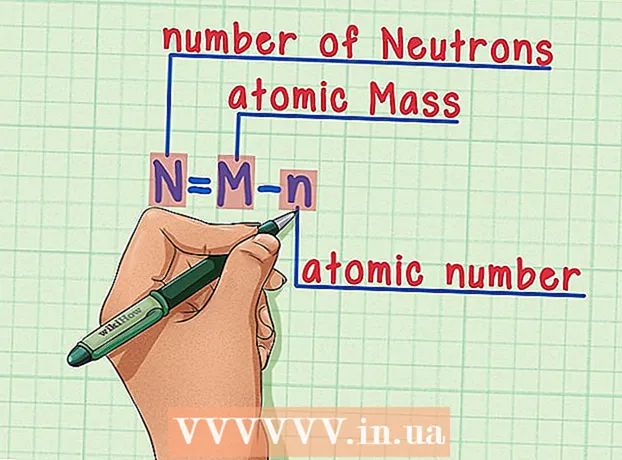
6 Հիշեք բանաձևը. Ապագայում նեյտրոնների թիվը գտնելու համար պարզապես օգտագործեք այս բանաձևը. - N = M - n
- N = նեյտրոնների թիվը
- M = ատոմային զանգված
- n = ատոմային թիվ
- N = M - n
Մեթոդ 2 -ից 2 -ը. Իզոտոպներում նեյտրոնների թվի որոշում
 1 Գտեք պարբերական աղյուսակի տարրը: Որպես օրինակ, մենք կքննարկենք ածխածնի 14C իզոտոպը: Քանի որ ոչ իզոտոպիկ ածխածինը 14C- ն պարզապես ածխածնի C է, պարբերական աղյուսակում գտեք ածխածինը (երկրորդ շրջանը կամ երկրորդ շարքը վերևից):
1 Գտեք պարբերական աղյուսակի տարրը: Որպես օրինակ, մենք կքննարկենք ածխածնի 14C իզոտոպը: Քանի որ ոչ իզոտոպիկ ածխածինը 14C- ն պարզապես ածխածնի C է, պարբերական աղյուսակում գտեք ածխածինը (երկրորդ շրջանը կամ երկրորդ շարքը վերևից):  2 Գտեք տարրի ատոմային թիվը: Սա, որպես կանոն, տարրի բջիջի ամենանշանակալի թիվն է և սովորաբար գտնվում է դրա խորհրդանիշից վեր (պարբերական համակարգի տարբերակում, որը մենք օգտագործում ենք մեր օրինակում, այլ թվեր չկան): Ատոմային համարը այդ տարրի մեկ ատոմի պրոտոնների քանակն է: Ածխածինը 6 -րդ համարն է, ինչը նշանակում է, որ մեկ ածխածն ունի վեց պրոտոն:
2 Գտեք տարրի ատոմային թիվը: Սա, որպես կանոն, տարրի բջիջի ամենանշանակալի թիվն է և սովորաբար գտնվում է դրա խորհրդանիշից վեր (պարբերական համակարգի տարբերակում, որը մենք օգտագործում ենք մեր օրինակում, այլ թվեր չկան): Ատոմային համարը այդ տարրի մեկ ատոմի պրոտոնների քանակն է: Ածխածինը 6 -րդ համարն է, ինչը նշանակում է, որ մեկ ածխածն ունի վեց պրոտոն:  3 Գտեք ատոմային զանգվածը: Իզոտոպների դեպքում դա շատ հեշտ է անել, քանի որ դրանք անվանվում են ըստ իրենց ատոմային զանգվածի: Մեր դեպքում, ածխածնի 14C- ն ունի ատոմային զանգված 14: Այժմ մենք գիտենք իզոտոպի ատոմային զանգվածը. հաջորդ հաշվարկի գործընթացը նույնն է, ինչ ատոմների (ոչ իզոտոպների) նեյտրոնների քանակի որոշման համար:
3 Գտեք ատոմային զանգվածը: Իզոտոպների դեպքում դա շատ հեշտ է անել, քանի որ դրանք անվանվում են ըստ իրենց ատոմային զանգվածի: Մեր դեպքում, ածխածնի 14C- ն ունի ատոմային զանգված 14: Այժմ մենք գիտենք իզոտոպի ատոմային զանգվածը. հաջորդ հաշվարկի գործընթացը նույնն է, ինչ ատոմների (ոչ իզոտոպների) նեյտրոնների քանակի որոշման համար:  4 Ատոմային զանգվածից հանեք ատոմային թիվը: Քանի որ պրոտոններն ու նեյտրոնները կազմում են ատոմային զանգվածի բացարձակ մասը, ապա ատոմային զանգվածից հանելով պրոտոնների թիվը (այսինքն ՝ ատոմային թիվը, որը հավասար է պրոտոնների քանակին) տալիս է ատոմի նեյտրոնների թիվը: Մեր օրինակում `14 (ատոմային զանգված) - 6 (պրոտոնների քանակ) = 8 (նեյտրոնների քանակ):
4 Ատոմային զանգվածից հանեք ատոմային թիվը: Քանի որ պրոտոններն ու նեյտրոնները կազմում են ատոմային զանգվածի բացարձակ մասը, ապա ատոմային զանգվածից հանելով պրոտոնների թիվը (այսինքն ՝ ատոմային թիվը, որը հավասար է պրոտոնների քանակին) տալիս է ատոմի նեյտրոնների թիվը: Մեր օրինակում `14 (ատոմային զանգված) - 6 (պրոտոնների քանակ) = 8 (նեյտրոնների քանակ):  5 Հիշեք բանաձևը. Ապագայում նեյտրոնների թիվը գտնելու համար պարզապես օգտագործեք այս բանաձևը.
5 Հիշեք բանաձևը. Ապագայում նեյտրոնների թիվը գտնելու համար պարզապես օգտագործեք այս բանաձևը. - N = M - n
- N = նեյտրոնների թիվը
- M = ատոմային զանգված
- n = ատոմային թիվ
- N = M - n
Խորհուրդներ
- Պրոտոններն ու նեյտրոնները կազմում են տարրերի գրեթե բացարձակ զանգվածը, մինչդեռ էլեկտրոններն ու այլ մասնիկները չափազանց աննշան զանգված են (այս զանգվածը ձգտում է զրոյի): Քանի որ մեկ պրոտոն ունի նույն զանգվածը, ինչ մեկ նեյտրոնը, և ատոմային թիվը պրոտոնների թիվն է, կարող եք պարզապես զանգվածից հանել պրոտոնների թիվը:
- Օսմիում - սենյակային ջերմաստիճանում պինդ վիճակում գտնվող մետաղ, իր անունը ստացել է հունական «osme» բառից `հոտ:
- Եթե վստահ չեք, թե ինչ է նշանակում պարբերական աղյուսակի թիվը, հիշեք. Աղյուսակը սովորաբար կառուցվում է ատոմային համարի (այսինքն ՝ պրոտոնների քանակի) շուրջ, որը սկսվում է 1 -ից (ջրածին) և աճում է մեկ միավոր ձախից աջ , ավարտվում է 118 -ով (Oganesson): Դա պայմանավորված է նրանով, որ ատոմում պրոտոնների քանակը որոշում է տարրը, և նման թիվը տարրերը կազմակերպելու ամենահեշտ ձևն է (օրինակ ՝ 2 պրոտոն ունեցող ատոմը միշտ հելիում է, ինչպես 79 պրոտոն ունեցող ատոմը միշտ ոսկի է) ):